Características
El carbono es un elemento notable por varias razones. Sus formas alotrópicas incluyen, una de las sustancias más blandas (el grafito) y una de las más duras (el diamante) y, desde el punto de vista económico, es de los materiales más baratos (carbón) y uno de los más caros (diamante). Más aún, presenta una gran afinidad para enlazarse químicamente con otros átomos pequeños, incluyendo otros átomos de carbono con los que puede formar largas cadenas, y su pequeño radio atómico le permite formar enlaces múltiples. Así, con el oxígeno forma el dióxido de carbono, vital para el crecimiento de las plantas (ver ciclo del carbono); con el hidrógeno forma numerosos compuestos denominados genéricamente hidrocarburos, esenciales para la industria y el transporte en la forma de combustibles fósiles; y combinado con oxígeno e hidrógeno forma gran variedad de compuestos como, por ejemplo, los ácidos grasos, esenciales para la vida, y los ésteres que dan sabor a las frutas; además es vector, a través del ciclo carbono-nitrógeno, de parte de la energía producida por el Sol.1Estados alotrópicos
Estructura del grafito
Una de las formas en las cuales se encuentra el carbono es el grafito se caracteriza porqué los átomos de carbono se encuentran "en los vértices de hexágonos que tapiza un plano"3 , es de color negro, opaco y blando, es el material del cual está hecha la parte interior de los lápices de madera. El grafito tiene exactamente los mismos átomos del diamante, pero por estar dispuestos en diferente forma, por lo que tienen distintas propiedades físicas y químicas. Los diamantes naturales se forman en lugares donde el carbono ha sido sometido a grandes presiones y altas temperaturas, su estructura es tetraédrica, que da como resultado una rede tridimensional y a diferencia del grafito tiene un grado de dureza alto: 10 Mohs. Los diamantes se pueden crear artificialmente, sometiendo el grafito a temperaturas y presiones muy altas.El precio del grafito es menor al de los diamantes naturales, pero si se han elaborado adecuadamente tienen la misma dureza, color y transparencia.
La forma amorfa es esencialmente grafito, pero no llega a adoptar una estructura cristalina macroscópica. Esta es la forma presente en la mayoría de los carbones y en el hollín.
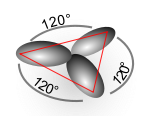
Disposición geométrica de los orbitales híbridos sp2.
Las dos formas de grafito conocidas alfa (hexagonal) y beta (romboédrica) tienen propiedades físicas idénticas. Los grafitos naturales contienen más del 30 % de la forma beta, mientras que el grafito sintético contiene únicamente la forma alfa. La forma alfa puede transformarse en beta mediante procedimientos mecánicos, y esta recristalizar en forma alfa al calentarse por encima de 1000 °C.
Estructura del diamante
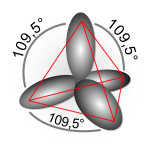
Disposición geométrica de los orbitales híbridos sp3.
El orbital híbrido sp1 que forma enlaces covalentes solo es de interés en química, manifestándose en algunos compuestos, como por ejemplo el acetileno.
Fullereno C60.
A esta familia pertenecen también los nanotubos de carbono, que pueden describirse como capas de grafito enrolladas en forma cilíndrica y rematadas en sus extremos por hemiesferas (fulerenos), y que constituyen uno de los primeros productos industriales de la nanote




0 comentarios:
Publicar un comentario